|
Die Webseite, die Unrecht beim Namen nennt ! |
|
 |
www.Babycaust.de
"WO RECHT ZU UNRECHT WIRD, WIRD
WIDERSTAND ZUR PFLICHT, GEHORSAM ABER VERBRECHEN!"
Papst Leo XIII.(1891)
|
|
|
| Lebensrecht
und Menschenwürde |
|
 |
Infos zur Euthanasie/Sterbehilfe • Anzeigen • Euthanasie-Anwalt Wolfgang Putz • Euthanasie-Anwalt Roger Kusch • Euthanasie-Lobbyisten • Organspende |
|
|
|
Mit welchen gesundheitlichen
Schädigungen ist zu rechnen,
wenn man widernatürliche Sexualität auslebt?
|
|
Homosexualität
(männlich - weiblich)
|
|
|
|
|
|
|
Nachfolgende
medizinischen Informationen über die
HIV-Infektion / AIDS
sind entnommen dem
Fachbuch
Stein - Proktologie -
Lehrbuch und Atlas 4. Auflage
ISBN 3-540-43033-4 (von Seite 467 - 476)
|
|
|
|
|
|
|
|
|
HIV-Infektion/Aids.
Das erworbene Immundefektsyndrom Aids (A cquired Immune Deficiency Syndrome)
stellt eine Infektionskrankheit viralen Ursprunges dar. Im engeren Sinne
bezeichnet es das klinische Endstadium einer Infektion mit den
Humanen-Immundefizienz- Viren (HIV), geprägt durch opportunistische
Infektionen und/oder seltene Tumoren und/oder neurologische
Krankheitsbilder.
Elektronenmikroskopisch betrachtet erscheint das HIV (HIV-1 oder HIV-2), das
zur Untergruppe der Lentiretroviren gehört, als rundliches, im Durchmesser
ca. 100 nm großes Partikel [20-22, 28] (Abb. 15.37).
Weltweit sollen derzeit mehr als 40 Millionen Erwachsene mit dem HIV-Virus
infiziert und 10 Millionen Menschen bereits an den Folgen der Infektion
gestorben sein.
ÄTIOLOGIE UND EPIDEMIOLOGIE
Die Übertragung des HIV erfolgt am häufigsten durch Geschlechtsverkehr,
durch gemeinsamen Gebrauch von kontaminierten Injektionsnadeln sowie während
der Schwangerschaft oder der Geburt von Mutter auf Kind [36]. Außerdem
spielten in der Vergangenheit Übertragungen mit kontaminiertem Blut oder
Blutprodukten (Hämophiliepatienten) eine wesentliche Rolle; dieser
Übertragungsweg ist in der BRD durch konsequente Untersuchungen aller
Blutspenden seit 1985 weitestgehend ausgeschlossen.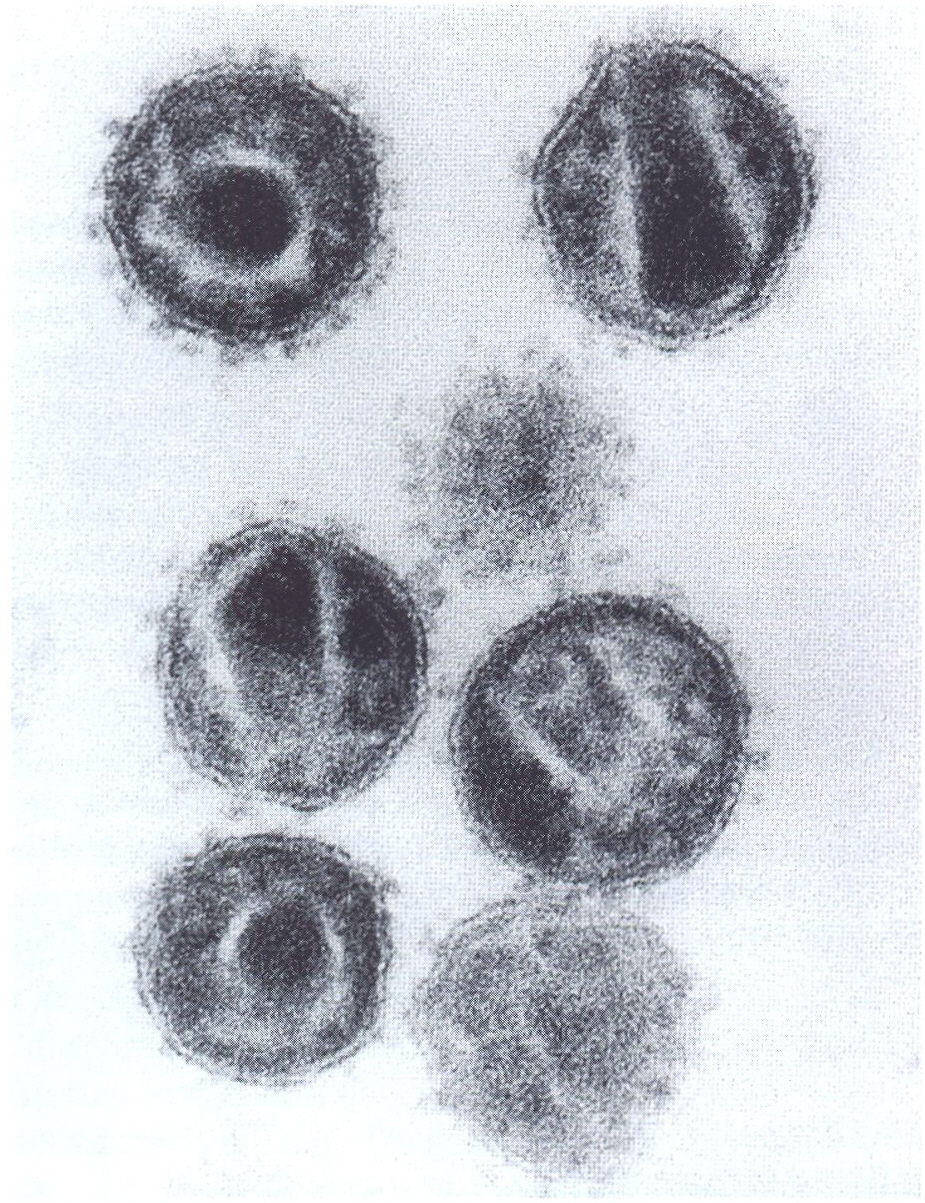
Abb.15.37.
Ultradünnschnitt von „human immunodeficiency viruses" (HIV). Die
Lentivirusnatur dieses 100120 nm großen, von einer Lipidhülle umgebenen
Erregers wird am prismatischen Innenkörper der Viruspartikeln deutlich.
Dieses Core zeigt je nach Schnittebene unterschiedliche Umrisse. Die
Oberflächen-fortsätze des HIV gehen spontan verloren
Bei den üblichen Sozialkontakten
(Handgeben) und über Tröpfcheninfektion (Niesen, Husten, Sprechen) ist eine
Übertragung von HIV nicht zu erwarten. Prophylaktische Maßnahmen in der
proktologischen Sprechstunde wurden auf S.20 dargelegt. Homo- und bisexuelle
Männer sowie Drogensüchtige stellen die Hauptgruppen der Erkrankten dar
[36]. Verletzende Sexualpraktiken, rezeptiver (passi-
ver) Analverkehr [42], häufiger Partnerwechsel und Nadeltausch bei Fixern
wird dabei als ätiologisch bedeutsam erachtet. In den Panepidemieregionen
wie Afrika und Asien sind vorwiegend Heterosexuelle und auch viele Kinder
betroffen. Eine HIV-Infektion durch heterosexuelle Kontakte scheint
allerdings zunehmend an Bedeutung auch in Deutschland zu gewinnen [4, 36].
Klinik
Die klinische Symptomatologie einer
HIV-Infektion zeigt gewöhnlich einen phasenartigen Verlauf. Eine
Expertengruppe der CDC (Centers of Disease Control) hat eine Klassifikation
von HIV-assoziierten Krankheitsbildern erarbeitet, die in Tabelle 15.4 und
15.5 wiedergegeben wird [48].
|
Laborkategorie
(CD4-Zellen/µl) |
Klinische Kategorie |
| A |
B |
C |
|
(asymptomatisch) |
(Symptome, kein Aids) |
(Symptome, Aids) |
| 1:≥ 500 |
A1 |
B1 |
C1 |
| 2: 200-499 |
A2 |
B2 |
C2 |
| 3:
< 200 |
A3 |
B3 |
C3 |
Die Übergänge zwischen den verschiedenen Stadien sind fließend, wobei ein
bestimmtes Stadium dem vorhergehenden nicht immer folgen muss.
1. Akute HIV-Infektion
Die Neuinfektion mit HIV verläuft in der Regel asymptomatisch. Gelegentlich
tritt aber einige Tage bis mehrere Wochen nach dem HIV-Kontakt ein
unspezifisches Krankheitsbild auf, das am ehesten einer infektiösen
Mononukleose ähnelt [12].
Fieber, Nachtschweiß, allgemeines Krankheitsgefühl, Lymphknotenschwellung,
Pharyngitis, Kopfschmerzen, Erbrechen, Durchfall, Arthralgien und ein
makulöses, stammbetontes Exanthem können in diesem akuten Initialstadium
auftreten. Unabhängig davon kann durch eine akute aseptische Meningitis
bereits in diesem frühen Stadium auch das Nervensystem einbezogen sein.
In dieser Phase ist die Erkrankung allenfalls durch den direkten
Erregernachweis verifizierbar. Antikörper treten erst zwischen der 4. und
12. Woche post infectionem auf.
2. Symptomfreies Latenzstadium
Dieses Stadium ist durch das Fehlen eines klinischen Beschwerde- und
Erscheinungsbildes bei gleichzeitigem HIV-Antikörpernachweis gekennzeichnet.
Gegebenenfalls kann allerdings eine Thrombopenie, Lymphopenie,
1'4/T8-Lymphozytenverminderung sowie eine kutane Anergie nachweisbar sein.
Die Dauer der symptomfreien Latenzzeit ist sehr variabel und kann sich von
wenigen Wochen bis zu mehreren Jahren erstrecken. Welche verschiedenen
Kofaktoren für die Progression einer HIV-Infektion verantwortlich sind, ist
bislang weitgehend unbekannt. |
|
|
|
Kategorie A
•
Asymptomatische HIV-Infektion
• Persistierende generalisierte Lymphadenopathie (LAS)
• Akute, symptomatische (primäre) HIV-Infektion (auch in der Anamnese)
Kategorie Ba)
• Bazilläre
Angiomatose
• Oropharyngeale Candida-Infektionen
• Vulvovaginale Candida-Infektionen, die entweder chronisch (länger als 1
Monat) oder nur schlecht therapierbar sind
• Zervikale Dysplasien oder Carcinoma in situ
• Konstitutionelle Symptome wie Fieber über 38,5 oder eine länger als 4
Wochen bestehende Diarrhö
• Orale Haarleukoplakie
• Herpes zoster bei Befall mehrerer Dermatome oder nach Rezidiven in einem
Dermatom
• Idiopathische thrombozytopenische Purpura
• Listeriose
• Entzündungen des kleinen Beckens, besonders bei Komplikationen eines
Tuben-oder Ovarialabszesses
• Periphere Neuropathie
Kategorie C
(Aids-definierende
Erkrankungen)
•
Pneumocystis-carinii-Pneumonie
•
Toxoplasma-Enzephalitis
• Ösophageale Candida-Infektion oder Befall von Bronchien, Trachea oder
Lungen
• Chronische Herpes-simplex-Ulzera o. Herpes-Bronchitis, -Pneumonie oder
Ösophagitis
• CMV-Retinitis
• Generalisierte CMV-Infektion (nicht von Leber oder Milz)
• Rezidivierende Salmonellen-Septikämien
• Rezidivierende Pneumonien innerhalb eines Jahres
• Extrapulmonale Kryptokokkeninfektionen
• Chronische intestinale Kryptosporidieninfektion
• Chronische intestinale Infektion mit Isospora belli
• Disseminierte oder extrapulmonale Histoplasmose
• Tuberkulose
• Infektionen mit Mycobacterium avium complex oder Mycobacterium kansasii,
dissemi-
niert oder extrapulmonal
• Kaposi-Sarkom
• Maligne Lymphome (Burkitts, immunoblastische oder primäres zerebrales
Lymphom)
• Invasives Zervixkarzinom
• HIV-Enzephalopathie
• Progressove multifokale Leukenzephalopathie
• Wasting-Syndrom
a) Krankheitssymptome
oder Erkrankungen, die nicht in die Aids-definierende Kategorie C fallen,
dennoch aber der HIV-Infektion ursächlich zuzuordnen sind oder auf eine
Störung der zellulären Immunabwehr hinweisen. |
|
3. Lymphadenopathie-Syndrom und
Aids-Related-Complex
Das Lymphadenopathie-Syndrom (LAS) liegt definitionsgemäß dann vor, wenn an
mindestens zwei extrainguinalen Lymphknotenstationen ohne erklärbare Ursache
vergrößerte Lymphknoten (> 1 cm) während mindestens dreimonatiger Dauer
festzustellen sind. Das LAS wurde daher auch als persistierende
generalisierte Lymphknotenschwellung bezeichnet (PGL).
Der Aids-Related-Complex (ARC) umfasst unspezifische Allgemeinsymptome wie
Gewichtsverlust von mehr als 10% des Körpergewichtes, Fieberschübe
ungeklärter Genese (> 1 Monat) und persistierende Diarrhön ohne
Erregernachweis.
Es bestehen Hinweise, dass HIV selbst eine Enteropathie auslösen kann [14,
23, 42, 43, 54].
4. Aids-Vollbild
Opportunistische Infektionen und seltene Tumoren kennzeichnen nach der
CDC-Definition das Endstadium einer HIV-Infektion. Eingeschlossen in diese
Definition sind inzwischen auch Krankheitsbilder wie extrapulmonale
Tuberkulose, „HIV-WastingSyndrom", rezidivierende Salmonellen-Septikämien
und neurologische Krankheitsbilder („HIV-assoziierte subakute Enzephalitis"
u.W. [9, 26].
Unter den opportunistischen Infektionen stellt die
Pneumocystis-carinii-Pneumonie die häufigste lebensbedrohliche Erkrankung
dar. |
|
Durch eine Vielzahl von Krankheitserregern ganz
unterschiedlicher Art (Protozoen, Pilze, Viren, Bakterien) kann ein breites
Spektrum opportunistischer Erkrankungen hervorgerufen werden (Tabelle 15.5).
Im Folgenden sollen einige proktologisch relevante Erkrankungen bei
HIV-infizierten Patienten kurz dargestellt werden [3, 13, 46]:
Erkrankungen durch Protozoen
Die Kryptosporidiose (S. 538 ff.) ist das typische Beispiel für eine
opportunistische Infektion, von der man bis zum Auftreten von Aids nicht
sicher war, ob sie auch beim Menschen eine persistierende Erkrankung
auslösen kann. Diese durch Kryptosporidien hervorgerufene Erkrankung äußert
sich in profusen wässrigen Durchfällen und Flüssigkeitsverlusten bis
151/Tag.
Hiervon zu unterscheiden ist die durch Giardia lamblia verursachte Lambliose
(s. 16.3.2), bei der es auch zu explosionsartig einsetzenden Durchfällen
kommen kann. Allerdings steht bei der Lamblieninfektion i. d. R. eine
ausgeprägte Flatulenz im Vordergrund, die bei der Kryptosporidiose zumeist
fehlt.
Auch die Isosporiasis (s. 16.3.4 und 16.3.5) äußert sich in Diarrhön,
Erbrechen, Fieber und Gewichtsverlust.
Pilzerkrankungen
In allen Stadien einer HIV-Infektion können Mykosen insbesondere der
Candida-Spezies auftreten. Am häufigsten wird ein Mundsoor
(Abb.15.42 d)
beobachtet, der auf den Ösophagus (Abb.15.44) sowie den restlichen Darmtrakt
(Abb.15.43) und auch auf andere Organe (z. B. Lunge) übergreifen kann. Im
Bereich der Analregion äußert sich der Pilzbefall in Form einer analen
und/oder perianalen ekzematoid erscheinenden Hefemykose (Levurose)
(Abb.15.42 a-e) (s. 15.13) [17].
Viruserkrankungen
Die Zytomegalievirusinfektion stellt eine wichtige opportunistische
Infektion im Gastrointestinalbereich bei Aids dar [49]. Im Vordergrund
stehen anhaltende Diarrhön, z. T. mit Blutbeimengungen, Bauchkrämpfen und
Gewichtsabnahme. Es finden sich fokale oder diffuse entzündliche
Veränderungen bis hin zu tiefen Ulzerationen im ganzen Gastrointestinaltrakt
und der perianalen Haut. Die Diagnose kann durch den histologischen Nachweis
von typischen „Entenaugenzellen" mit intranukleären und
intrazytoplasmatischen Einschlusskörperchen sowie durch immunhistologische
Methoden gestellt werden [16].
Die Therapie der Wahl besteht aus Ganciclovir allein oder in Kombination mit
Foscarnet bei komplizierten Verläufen oder Retinitis. Oftmals zeigt sich
erst nach erfolgter Besserung unter der Therapie, dass die
gastrointestinalen Beschwerden durch CMV verursacht waren.
Die bei Vorliegen einer HIV-Infektion auftretende sog. HSV-Anitis ist
gekennzeichnet durch zunächst flache, schmierig belegte, perianale und/oder
anale Ulzerationen
(Abb. 2.32 a-d), die in der Regel zu großflächigen, nekrotisierenden, äußerst schmerzhaften Läsionen fortschreiten können
(Abb.15.38 a, b). Das Erscheinungs- und Beschwerdebild der HSV-Proktitis
(Abb. 2.33 a-c) wird in Abschn. 2.10 beschrieben.
Der Zoster
(Abb. 2.35 a-f) neigt im Rahmen einer HIV-Infektion zu
mehrsegmentalem Befall sowie Überschreiten der Medianlinie des Körpers; in
Einzelfällen kann ein Zoster generalisatus auftreten (s. Abschn. 2.11,
S.154).
Die durch humane Papillomviren perianal und intraanal lokalisierten
Condylomata acuminata
(Abb. 2.42 a-d, 2.50) dehnen sich bei HIV-Infizierten
häufig großflächig, ggf. bis in den Rektumbereich aus und neigen zu hohen
Rezidivquoten [40].
Verrucae vulgares (Abb. 2.40) und Mollusca contagiosa (Abb.2.37, 2.38) [32]
erregen bei Auftreten in disseminierter Form wie auch in ungewöhnlicher
Lokalisation (z. B. Genitoanalregion) stets einen Verdacht auf das Vorliegen
einer Abwehrschwäche und sollten demzufolge auch an eine HIV-Infektion
denken lassen. Eine virale Genese wird auch bei der von Greenspan et al.
[24] erstmals beschriebenen oralen Haarleukoplakie angenommen. Hierbei
finden sich bei HIV-Infizierten am seitlichen Zungenrand lokalisierte,
weißliche, haarförmige bis leicht papillomatöse, nicht abstreifbare
Auflagerungen (Abb. 15.39 a, b). Elektronenmikroskopisch konnten in den
betreffenden Läsionen sowohl Epstein-Barr-Virus (EBV) als auch Humanes
Papillom-Virus (HPV) nachgewiesen werden [4, 25, 52, 62, 63].
 |
|
 |
| |
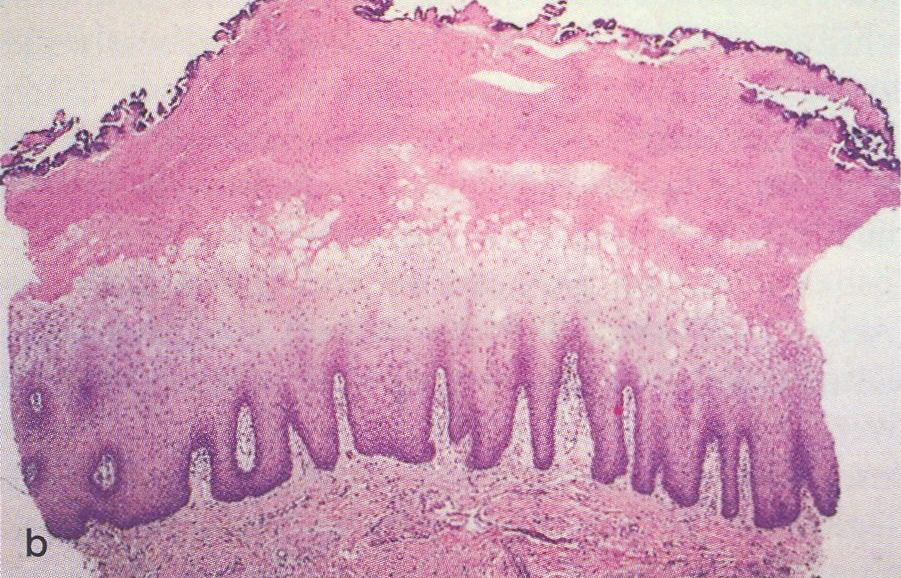 |
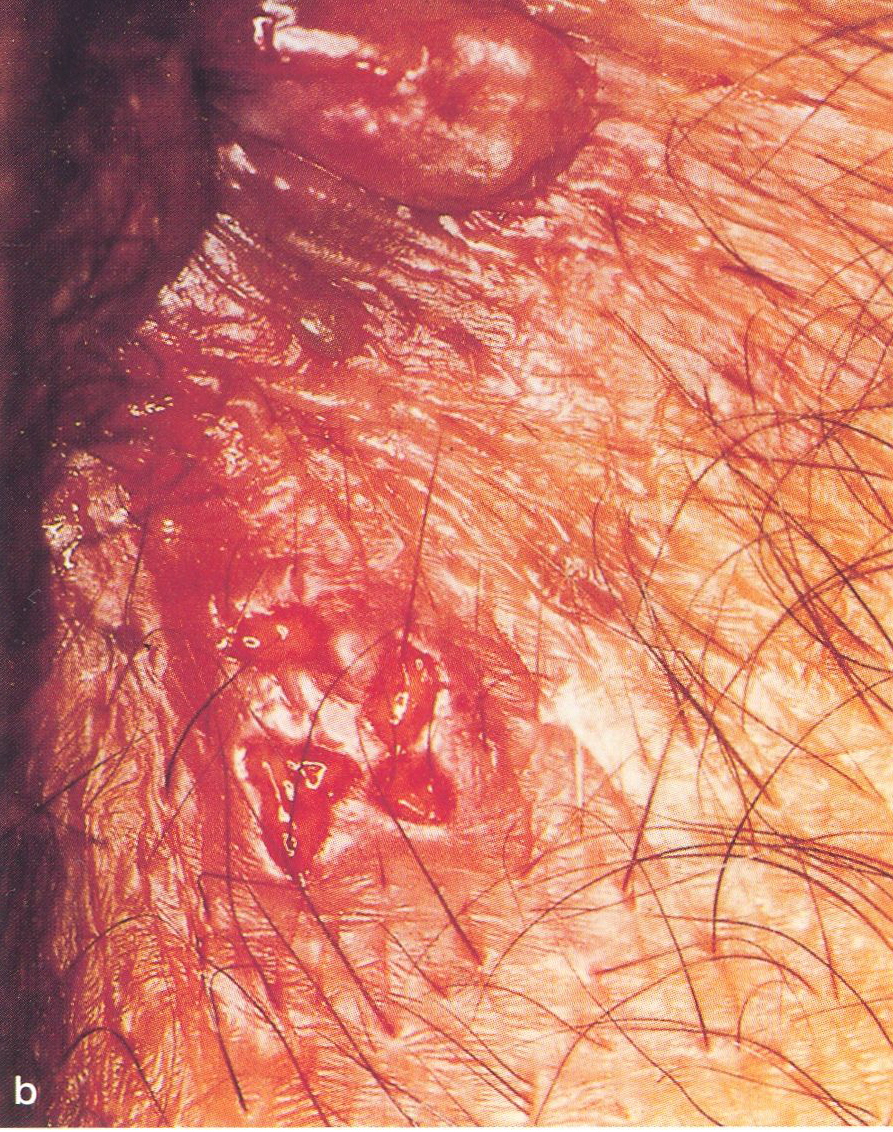
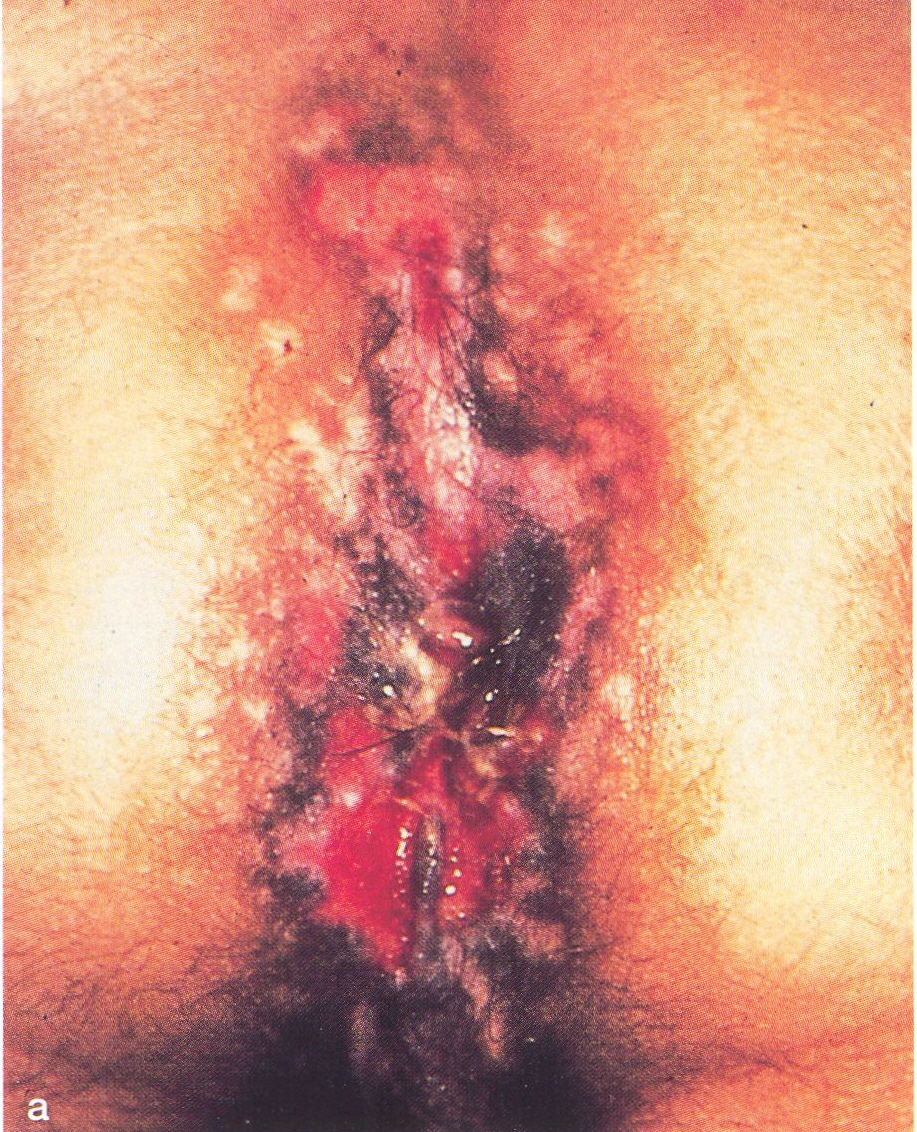
Abb.15.38 a,b. Typische HSV-Läsionen bei
HIV-infizierten Patienten.
a Perianalbefund einer
Herpes-simplex- Virus (HSV-2-Typ)-Infektion; es handelt sich im
vorliegenden Fall um die Klinische Erstmanifestation des erworbenen
Immundefektsyndromes, b Flache, schmierig belegte, z.T.
konfluierende Ulzerationen eines Herpes simplex perianalis ( s.auch
Abbs. 2.32.33) |
|
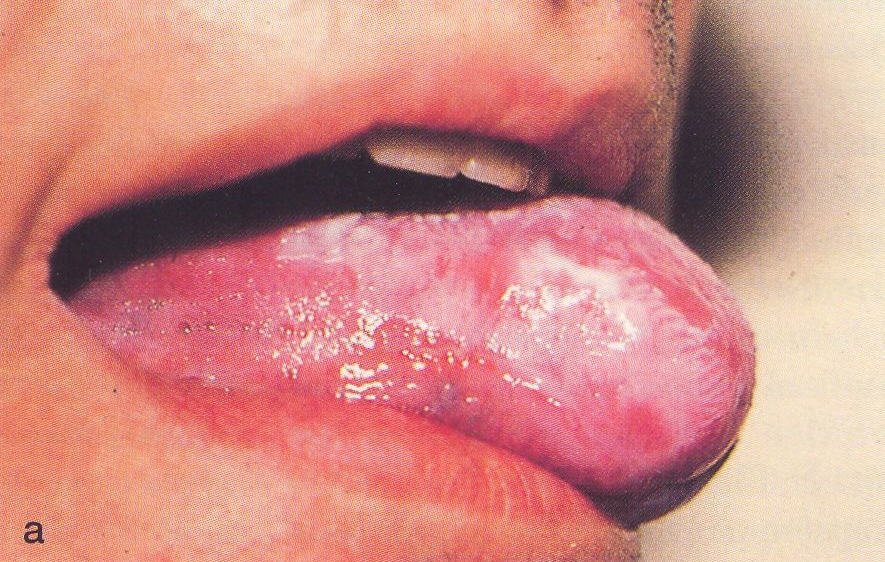
Abb.15.39a,b.
Orale
Haarleukoplakie. a Klinisches Bild
b
Papillomatös geschwingene Oberfläche mit kleinen Keratinprojektionen,
dichtes Bakterienwachstum, Parakeratose, ballonierte Epithelzellen mit
perinukleären Aufhellungen (Koilozyten), plump- sowie
schlank-elongierte Reteleisten. HE-Färbung
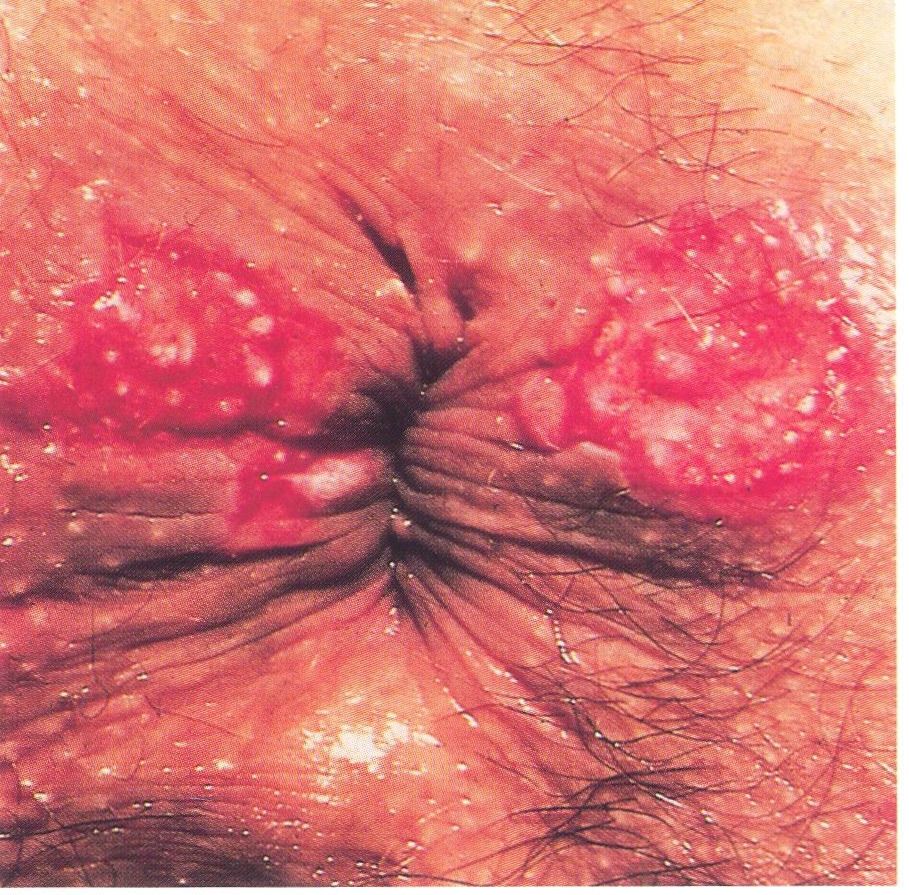
Abb.15.40.
Condylomata lata bei einem HIV-infizierten Patienten |
|
|
|
|
|
|
Bakterielle Erkrankungen
Auch bakterielle Infektionen treten im Verlauf einer HIV-Infektion gehäuft
auf: nekrotisierende Pyodermien, Abszesse
(Abb. 1.20 d), Follikulitiden
(Abb.2.27b), Impetigo
(Abb.2.27 a), Phlegmonen, atypische Verläufe der
Syphilis
(Abb. 15.28 a-d und 15.40), schwere Verlaufsformen von
Salmonellosen, Shigellosen (Abb. 15.1), Yersiniosen (Abb. 15.2),
Campylobacteriosen (Abb. 15.7) und disseminierte Formen von Tuberkulose
(Abb.15.16,
15.18, 15.20,
15.21) werden beschrieben.
Atypische Mykobakteriosen (S.438) sind ebenfalls Ausdruck einer
ausgesprochenen Immunschwäche und konnten früher nur sehr selten beobachtet
werden. Atypische Mykobakteriosen, zumeist durch Mycobacterium avium
intracellulare (MAI), äußern sich in unspezifischen Symptomen wie Fieber,
Abdominalschmerzen, chronischer Diarrhö, Malabsorption und Gewichtsverlust.
Die Diagnose kann mittels Blut- und/oder Stuhlkulturen sowie durch Biopsien
aus der Rektalschleimhaut gestellt werden. Die therapeutischen Möglichkeiten
sind sehr beschränkt, da die üblichen Tuberkulostatika schlecht ansprechen.
Eine Kombinationstherapie aus Clarithromycin und Ethambutol oder Rifabutin
gilt als Standard, oftmals sind aber kompliziertere Therapieschemata zur
Verbesserung erforderlich.
Insbesondere bei Homosexuellen fallen Proktitiden (Abb. 1.11 a) mit
hämorrhagischen und ulzerösen Läsionen auf. Kryptitiden (Abb. 1.11 b) mit
konsekutiver Abszess- und Fistelbildung wurden beschrieben [40]. Der
praktizierte Analverkehr führt in der Regel zu mechanischen Verletzungen,
wodurch auch die verschiedensten Mikroorganismen (Herpes-simplex-Viren,
Chlamydien, Mykoplasmen, Treponemen, Gonokokken, Salmonellen, Amöben u.W.)
übertragen werden können [37]. Dies führt zu entzündlichen bzw.
entzündlich-infektiösen Veränderungen am Enddarm, die bei den Betroffenen zu
Stuhlunregelmäßigkeiten, Hämatochezie, schmerzhaften Tenesmen u.W. führen
können [41]. Histologisch wie endoskopisch imponiert dieses auch als
Gay-Bowel -Syndrom (Abb.15.41 a, b) bezeichnete Erscheinungsbild als
uncharakteristische, erosive Proktitis [12, 37, 40].
Bei der Chlamydienproktitis handelt es sich um eine Entzündung, die durch
Chlamydia trachomatis der Serotypen D-K oder durch LGV-Chlamydien (Lymphogranuloma
venereum) der Serotypen L1-L3 hervorgerufen wird [31, 51]. Während die
zahlenmäßig häufigeren Chlamydieninfektionen der Serotypen D-K meist
asymptomatisch oder mild verlaufen, imponiert die LGV-Proktitis durch
hämorrhagische Ulzerationen, die klinisch wie histologisch an einen Morbus
Crohn erinnern (Abb. 15.36 d, e). Da sich Chlamydien intrazellulär
vermehren, stellt der Erregernachweis in der Praxis häufig ein
diagnostisches Problem dar.
| |
  |
|
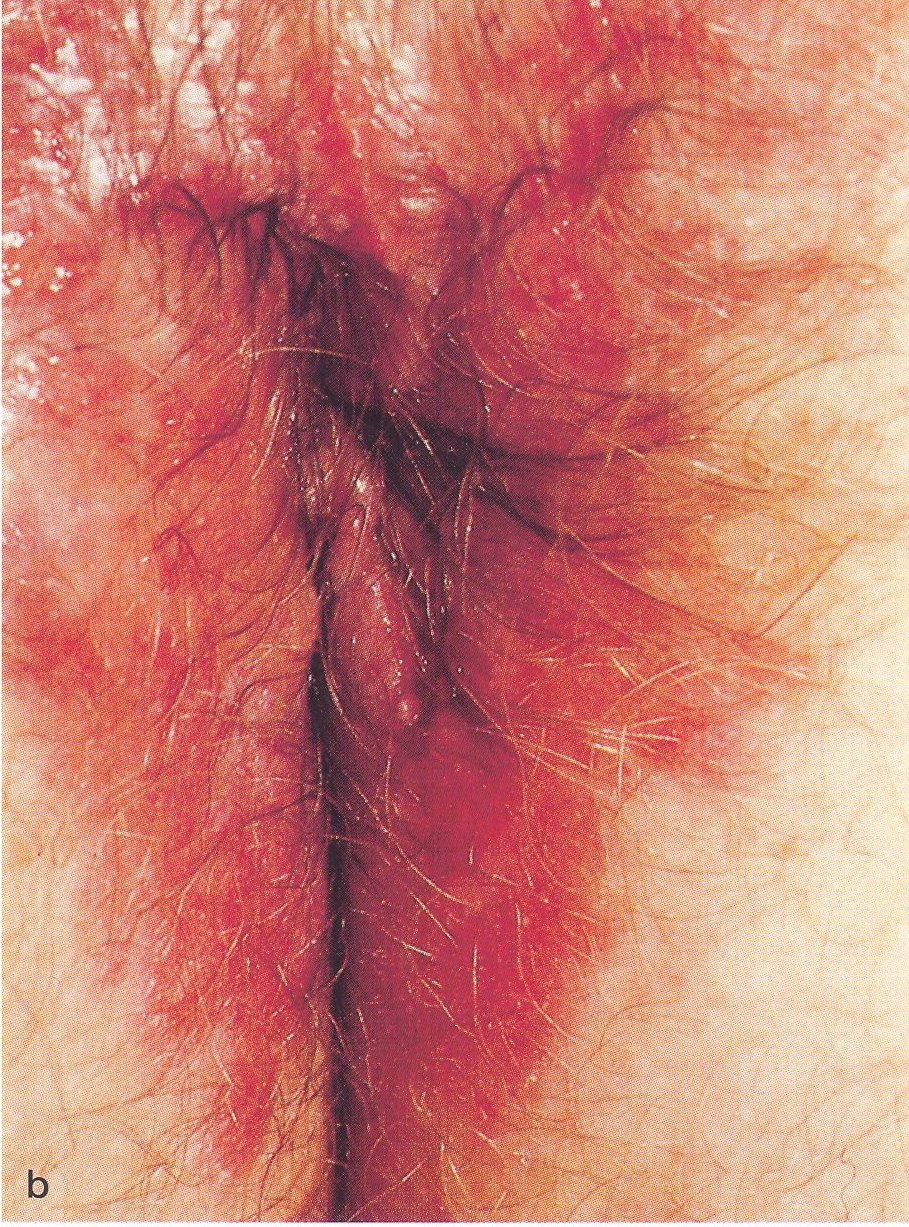
Abb.15.41 a, b. Gay-Bowel-Syndrom bei HIV-infiziertem Patienten. a
Gleichzeitiges Vorliegen einer Salmonellensepsis, einer eitrigen
Proktitis sowie Perianalthrombosen mit 'aufgelagerten, flachen
Ulzerationen einer Herpes simplex-Infektion (Typ 2).
b Toxisch-degeneratives perianales
Kontaktekzem als Folge einer bestehenden Analfistel
|
Epizootien
Auch die Skabies kann bei HIV-Infizierten recht atypisch verlaufen (Abb.
2.54). Die stark juckenden papulosquamösen Läsionen treten zumeist
generalisiert auf, wobei auch Gesicht und Kapillitium meistmitbefallen sind
[19]. Wie auch bei anderen Formen der Immunsuppression kommt es bei
HIV-Positiven oft zu einem ausgeprägten Verlauf mit hoher Milbenzahl im
Sinne einer Scabies norwegica, die klinisch häufig einer Psoriasis oder
einem massiven Kontaktekzem ähneln kann (s. S.163 ff.).
Nichtinfektiöse Erkrankungen
Insbesondere seborrhoische Ekzeme (Abb. 2.5 o„ 02) und provozierte bzw.
auffällig exazerbierte Psoriasis-vulgaris -Erscheinungsbilder (Abb. 2.77)
werden bei Aids-Patienten überzufällig häufig beobachtet. Insbesondere, wenn
diese Krankheitsbilder atypisch lokalisiert sind und klinisch ein
uncharakteristisches Bild aufweisen und/oder Patienten einer ungewöhnlichen
Altersgruppe betroffen sind, sollte man eine HIV-Infektion mit in die
differenzialdiagnostischen Überlegungen einbeziehen [4].
Auch Rhagaden (Abb.1.14 a, b) und chronische Analfissuren (Abb.1.15 a-f,
1.16) mit Wundheilungsstörungen werden gehäuft bei HIV-Infizierten
diagnostiziert (s. Abschn.1.8, 1.9). Auch anale Ulzera sind häufig [47].
HIV-assoziierte Neoplasien
Die häufigsten Malignome, die bei Aids-Patienten auftreten, sind das
Kaposi-Sarkom [58] (S.287 ff.) und bevorzugt am Gastrointestinaltrakt
lokalisierte maligne Non-Hodgkin-Lymphome.
Das Risiko von HIV-Infizierten an hochmalignen undifferenzierten bzw.
diffusen B-Zell-Lymphomen zu erkranken, ist um das 4 fache erhöht [15, 38,
64]. Auch Morbus Hodgkin wurde perianal beschrieben [53].
Aber auch Plattenepithelkarzinome (Abb. 3.15), basaloide und kloakogene
Karzinome (Abb.3.11 a, b) und das Bowen-Karzinom
(Abb. 2.46 a) sind hier zu nennen
(s. 3.1.2) [44].
DIAGNOSE
Die Diagnose wird durch Anamnese, Klinik und Laboruntersuchungen gestellt.
Die derzeit wichtigsten Labor-Nachweismöglichkeiten sind:
• Nachweis spezifischer Antikörper gegen virale Proteine (Anti-HIV-AK),
• Nachweis des Virus selbst (HIV-Antigen),
• Nachweis der Viruslast mittels PCR.
Der einfachste Suchtest zum Nachweis HIV-spezifischer Antikörper ist der
HIV-ELISA („enzyme linked immuno sorbent assay").
Jeder positive ELISA-Test muss jedoch durch eine zweite unabhängige Methode
bestätigt werden (Konfirmationstest).
Als Bestätigungstest hat sich in erster Linie das Immunoblotverfahren, der
sog. Western-Blot bewährt. Andere immunologische Verfahren wie dige
Radioimmunpräzipitation (RIPA) oder der Immunfluoreszenztest (IFT) sind
aufgrund der aufwendigen Arbeitstechnik und der zu verwendenden Isotope nur
noch in Spezialfällen indiziert [61]. Die
diagnostische Lücke zwischen erfolgter Infektion und Positivierung der
Screeningtests beträgt 68 Wochen, kann aber bis zu 4 Monate, in seltenen
Fällen sogar noch länger dauern. In Zweifelsfällen sollten deshalb
Wiederholungstests durchgeführt werden [59]. Ausmaß und Stadium der
entscheidenden Schädigung der T4-Helferzellen lassen sich im Verhältnis zu
den T8-Zellen erkennen (T4/T8-Quotient, Norm 1,4-2,0).
Inzwischen sind Testverfahren kommerziell verfügbar, die über den direkten
Nachweis von Viruspartikeln bzw. dem spezifischen Nachweis von
Virusnukleinsäure eine Verkleinerung der diagnostischen Lücke ermöglichen.
Der derzeit gebräuchlichste Test zum Nachweis freier, im Blut zirkulierender
Viruspartikel ist der HIVAntigen-Capture-Assay (Festphasen-Enzym-Immunoassay
„EIA").
Neue molekularbiologische Methoden erlauben inzwischen das arbeits- und
zeitaufwendige Verfahren der Virusanzucht zu umgehen und die
HIV-Nukleinsäure innerhalb weniger Stunden direkt nachzuweisen.
Die derzeit bekannteste Methode ist die Polymerasekettenreaktion („polymerase
chain reaction", PCR). Andere Methoden zur Viruslastbestimmung sind b-DNA
und NASBA.
Die PCR dient zur Bestimmung der Viruslast. Diese wird gemessen als Zahl der
viralen RNA-Kopien pro Milliliter Serum. Das Ausmaß der Virämie erlaubt
einerseits Rückschlüsse auf die Prognose und dient andererseits als
Kontrollkriterium über Erfolg oder Misserfolg therapeutischer Maßnahmen.
Die Viruslast, als derzeit bester Parameter zur Kontrolle des
Therapieverlaufs, sollte - bei unkomplizierten Verläufen - in 3 monatigen
Abständen gemessen werden. Gleichzeitig stellen die absolute
CD4-Lymphozyten-Anzahl und die Viruslast die wichtigsten prognostischen
Parameter dar. |
|
|
DIFFERENZIALDIAGNOSE
Bei zweifelhaftem Labornachweis einer HIV-Infektion müssen
differenzialdiagnostisch andere Ursachen einer Immundefizienz in Betracht
gezogen werden. Im Kindesalter sind als primäre zelluläre
Immundefektzustände vor allem das Di-GeorgeSyndrom und die chronische
mukokutane Candidamykose bekannt. Auch andere genetische oder erworbene
Immunmangelsyndrome (z. B. Agammaglobulinämie) kommen
differenzialdiagnostisch in Frage. Im Erwachsenenalter können konsumierende
maligne Erkrankungen wie Morbus Hodgkin, NonHodgkin-Lymphome, lymphozytäre
Leukämie, multiples Myelom wie auch jede andere maligne Erkrankung zu einem
Immundefekt führen. Ein iatrogener Immundefekt kann schließlich bei hoch
dosierten Langzeittherapien mit systemisch wirkenden Kortikoiden oder
anderen immunsuppressiven bzw. zytostatischen Präparaten entstehen.
THERAPIE
Es ist derzeit noch nicht möglich, HIV aus dem Organismus restlos zu
eliminieren und damit die Infektion zu heilen.
Die neuen Kombinationstherapien mit antiviralen Medikamenten können
allerdings die Virusvermehrung fast vollständig unterdrücken und so das
Immunsystem stabil halten. Wie lange ist zur Zeit noch unklar.
Allgemein wird heute gefordert, Infizierte so früh wie möglich kombiniert zu
behandeln, denn Patienten mit noch niedriger Viruslast und hoher
Helferzellzahl (CD4-Zellzahl) haben eine bessere Prognose.
Eine Therapie wird bei symptomatischen Patienten oder bei asymptomatischen
mit einer CD4-Zellzahl < 5004t1 und/oder einer Viruslast > 1000 (b-DNA) oder
> 20.000 Kopien/ml (PCR) empfohlen. Außerdem sollte eine Therapie begonnen
werden, wenn ein akutes retrovirales Syndrom diagnostiziert wird oder als
Postexpositionsprophylaxe möglichst rasch nach potenzieller Inokulation. Zur
Therapie wird eine Kombination aus den 3 zur Verfügung stehenden
Medikamentengruppen gewählt: Hierzu zählen die nukleosidartigen
Reverse-Transkriptase-Inhibitoren (NRTI), die nichtnukleosidartigen RTI (NNRTI)
und die Proteaseinhibitoren. Da sich derzeit viele Neuerungen ergeben und
eine umfassende Erklärung der HAART („highly active antiretroviral therapy")
den Rahmen dieses Buches sprengen würde, wird für detailliertere
Informationen auf die entsprechende Fachliteratur verwiesen [1, 5, 27, 33].
Zwei für den Dermatologen interessante Nebenwirkungen der antiretroviralen
Therapie stellen das Lipodystrophiesyndrom meist mit Störungen auch des
Insulinstoffwechsels und chronische Nagelbettentzündungen (oft unter Gabe
von Indinavir) dar [29, 60].
Trotz intensiver Forschung im Bereich einer Vakzine und trotz zahlreicher
vielversprechender Ansätze ist eine solche für den klinischen Alltag noch
nicht in naher Zukunft in Sicht.
Neben der jeweils entsprechenden Bekämpfung der zu Rezidiven neigenden
Begleiterkrankungen kommt auch weiterhin einer konsequenten Aufklärung der
Bevölkerung und der psychosozialen Betreuung HIV-Infizierter entscheidende
Bedeutung zu [34].
Literatur
1. Arasteh K, Müller M (2001) Neue antiretrovirale Medikamente. Verbesserte
Pharmakokinetik und einfachere Dosierschemata. MMW Fortschr Med 143: 257-260
2. Barre-Sinoussi F et al. (1983) Isolation of a T-lymphotropic retrovirus
from a patient at risk for acquired immune deficiency syndrome (AIDS).
Science 220: 868
3. Barrett WL, Callahan TD, Orkin BA (1998) Perianal manifestations of human
immunodeficiency virus infection: experience with 260 patients. Dis Colon
Rectum 41/5: 606-611
4. Braun-Falco 0 et al. (1988) Dermato-venerologische Erkrankungen als
Indikatoren für Diagnose und Prognose der HIV-Infektion. Münch Med
Wochenschr 130/17: 331-336
5. Brockmeyer NH, Salzberger B, Doerr HW, Marcus U, Brodt HR (2001)
Antiretrovirale Therapie der HIV-Infektion. Dtsch Ärztbl 98/4: A175-181
6. Brodt HR, Helm EB, Kamps BS (2000) AIDS 2000,10. Aufl. Steinhäuser,
Wuppertal
7. Centers for Disease Control (1981) Pneumocystis pneumonia - Los Angeles.
MMWR 30: 250
8. Centers for Disease Control (1981) Kaposi's sarcoma and pneumocystis
pneumonia among homosexual men - New York City and California. MMWR 30: 305
9. Centers for Disease Control (CDC) (1992) 1993 revised classification
system for HIV infection and expanded surveillance case definition for AIDS
among adolescents and adults. MMWR 41 (RR-17): 1-19
10. Chang Y et al. (1994) Identification of herpesvirus-like DNA sequences
in AIDS-associated Kaposi's sarcoma. Science 266: 1865-1869
11. Cooper DA (1993) Zidovudine in persons with asymptomatic HIV infection
and CD4 + cell counts greater than 400 per cubic millimeter. N Engl J Med
329/5: 297-303
12. Cooper DA et al. (1985) Acute AIDS-retrovirus infection. Lancet I:
537-540
13. Czelusta A, Yen-Moore A, Straaten M van der, Carrasco D, Tyring SK
(2000) An overview of sexually transmitted diseases. Part III. Sexually
transmitted diseases in HIV-infected patients. J Am Acad Dermatol 43/3:
409-432
14..Dancygier H (1992) AIDS and gastrointestinal endoscopy. Endoscopy 24:
169-175
15. Danzig JB, Brandt LJ, Reinus JF, Klein RS (1991) Gastrointestinal
malignancy in patients with AIDS. Am J Gastroenterol 86/6: 715-718
16. Dauden E, Fernandez-Buezo G, Fraga J, Cardenoso L, Garcia-Diez A (2001)
Mucocutaneous presence of cytomegalovirus associated with human
immunodeficiency virus infection: discussion regarding its pathogenetic role.
Arch Dermatol 137/4: 443-448
17. Durden FM, Elewski B (1997) Fungal infections in HIV-infected patients.
Semin Cutan Med Surg 16/3: 200-212
18. Edman JC et al. (1988) Ribosomal RNA sequence Shows Pneumocystis carinii
to be a member of the fungi. Nature 334: 519-522
19. Fischer B, Warner LC (1987) Cutaneous manifestations of the acquired
immunodeficiency syndrome. Update 1987. Int J Dermatol 26: 615-630
20. Gallo RC, Wong-Staal F(1985) A human T-lymphotropic retrovirus (HTLV
III) as the cause of the acquired immunodeficiency syndrome. Ann Intern Med
103: 679-689
21. Gallo RC et al. (1984) Frequent detection and isolation of cytopathic
retroviruses (HTLV III) from patients with AIDS and at risk for AIDS.
Science 224: 500-503
22. Gelderblom HR (1991) HIV - Virologische Grundlagen. Dtsch Dermatol 39/3:
292-296
23. Greenson JK, Belitsos PC, Yardley JH, Bartlett JG (1991) AIDS
enteropathy: occult enteric infections and duodenal mucosal alterations in
chronic diarrhea. Ann Intern Med 114: 366-372
24. Greenspan D et al. (1984) Oral hairy leukoplakia in male homosexuals:
evidence of association with both papillomavirus and a herpes group virus.
Lancet 2: 831-834
25. Gross J, Wiegand H, Zentgraf H (1988) Epstein-BarrVirus Nachweis in
oralen haarigen Leukoplakien bei AIDS-Patienten, in Leukoplakien und
unauffälligen Zungenepithelien HIV-1-negativer Patienten. Z Hautkrankht
63/1: 44-48
26. Gutberlet H, Rösch W (1992) Primäre Darmtuberkulose bei AIDS. Z
Gastroenterol 30: 869-872
27. Hartmann M (2001) HIV-Infektion. In: Petzoldt D, Gross G (Hrsg)
Diagnostik und Therapie sexuell übertragbarer Krankheiten - Leitlinien 2001
der Deutschen STD-Gesellschaft. Springer, Berlin Heidelberg New York Tokio,
S 58-66
28. Hartmann H, Hemsmann G (1988) Struktur und biologische Eigenschaften von
humanen ImmundefizienzViren (HIV). Internist 29: 67-72
29. Hartmann M, Petzoldt D (2000) Lipodystrophiesyndrom bei der
HIV-Infektion. Hautarzt 51: 159-163
30. Hing M, Oliver Ch, Melville R (1992) Zidovudin bei HIV-Enteropathie. The
Lancet - Deutsche Ausgabe, 6. Jg, 3: 180
31. Hoyme UB (1994) Chlamydieninfektionen - Schwieriger Nachweis, „einfache"
Therapie. Therapiewoche 44(3): 130-136
32. Husak R, Garbe C, Orfanos CE (1997) Mollusca contagiosa bei
HIV-Infektion. Hautarzt 48: 103-109
33. Jablonowski H (2001) Antiretrovirale Therapie 2001. Grundlagen und
aktueller Stand. MMW Fortschr Med 143: 247-255
34. Jäger H (1988) Die psychosoziale Betreuung von AIDS-und
AIDS-Vorfeldpatienten. Internist 29: 97-102
35. Janoff EN, Orenstein JM, Manischewitz JF, Smith PD (1991) Adenovirus
colitis in the acquired immunodeficiency syndrome. Gastroenterology 100:
976-979
36. Kiehl W (1994) Sexuelle Übertragung von HIV-Infektionen - Situation,
Infektionsrisiken, Prävention. Therapiewoche 44(3): 144-148
37. Krüger GRF (1986) Klinische Pathologie bei AIDS-Patienten und bei
AIDS-Risikopersonen. AiFo 3: 139-147
38. Lee MH, Waxmann M, Gillooley JF (1985) Primary malignant lymphoma of the
anorectum in homosexual men. Dis Colon Rectum 29(6): 413-416
39. Lenderking WR et al. (1994) Evaluation of the quality of life associated
with zidovudine treatment in asymptomatic human immunodeficiency virus
infection. N Engl J Med 330/11: 738-743
40. Lenhard B, Näher H, Petzoldt D (1987) Periproktale und anorektale
Entzündungszustände bei HIV-Infektion. Hautarzt 38: 361-363
41. Löffler A, Krüger GRF (1986) Gastrointestinale Manifestationen der
AIDS-Erkrankung. In: Steigleder GK (Hrsg) AIDS-Bericht 2/1986. Grosse,
Berlin, S 77-90
42. Lorian V (1988) AIDS, anal sex, and heterosexuals. Lancet I: 1111
43. Mathijs JM et al. (1988) HIV infection of rectal mucosa. Lancet I: 1111
44. Melbye M, Cot6 TR, Kessler L, Gall M, Biggar RJ und die AIDS/Cancer
Working Group (1994) High incidence of anal cancer among AIDS patients.
Lancet 343: 636-639
45. Moss AR et al. (1988) Seropositivity for HIV and the development of AIDS
or AIDS related condition: three year follow up of the San Francisco General
Hospital cohort. Br Med J 296: 745-750
46. Nadal SR, Manzione CR, Galvao VM, Salim VR, Speranzini MB (1999)
Perianal diseases in HIV-positive patients compared with a seronegative
population. Dis Colon Rectum 42/5: 649-654
47. Nadal SR, Manzione CR, Horta SH, Galvao V (1999) Management of
idiopathic ulcer of the anal canal by excision in HIV-positive patients. Dis
Colon Rectum 42/12: 1598-1601
48. Plettenberg A et al. (1997) HIV-assoziierte Hauterkrankungen, Teil II.
Hautarzt 48: 58-72
49. Prüfer-Krämer L, Krämer A, Pohle HD (1988) Die Zytomegalievirusinfektion
des Gastrointestinaltraktes bei AIDS. Verdauungskrankheiten 6(4): 133-140
50. Ramsauer J, Plettenberg A, Meigel W (1996) HIV-assoziierte
Hauterkrankungen. Teil 1: Verlauf und Epidemiologie der HIV-Infektion,
erregerbedingte HIV-assoziierte Dermatosen. Hautarzt 47: 795-813
51. Rodier B, Catalan F, Harboun A (1987) Schwere Rektitis durch Chlamydien
des Serotypus D. Coloproctology 6: 341-344
52. Rufli T, Büchner SA (1994) Klinische Erscheinungsbilder bei
HIV-Infektionen. Therapiewoche 44(19): 1076-1080
53. Sapp M, Perez-Ordonez B, Brennemann F, Imrie K, Morava-Protzner I, Lim
MS (2001) EBV-associated perianal Hodgkin's disease in an HIV-positive
individual. Am J Hematol 66/1: 42-45
54. Schneider T, Ullrich R, Zeitz M (1994) Gastroinestinale Manifestationen
bei der HIV-Infektion. Z Gastroenterol 32: 174-181
55. Schöfer H (1995) Klinische Diagnose der HIV-Erkrankung. TW Dermatologie
25: 349-356
56. Schröder U, Waller V, Kaliebe T, Agathos M, Breit R (1994) Akutes
Primärstadium einer HIV-Infektion mit Nachweis einer Serokonversion.
Hautarzt 45: 29-33
57. Schulte C, Meurer M, Fröschl M (1988) Prognostische Bedeutung von
Antikörper gegen HIV-Kernproteine bei Patienten mit Lymphadenopathie-Syndrom.
Hautarzt 39: 45-48
58. Szeimies
R-M, Lorenzen T, Karrer S, Abels C, Plettenberg A (2001) Photochemotherapie
kutaner Aids-assoziierter Kaposi-Sarkome mit Indocyaningrün und Laserlicht.
Hautarzt 52: 322-326
59. Thomas L, Schnaith E (1994) HIV-Diagnostik. Therapiewoche 44(3): 149
60. Tosti A, Pirraccini BM, D,Antuono A, Marzaduri S, Bettoli V (1999)
Paronychia associated with antiretroviral therapy. Br J Dermatol 140/6:
1165-1168
61. Wagner R, Mayer J, Reischl U (1995) Labordiagnostik der HIV-Infektion.
Fortschr Med 10: 135-139
62. Winzer M, Gilliar U (1988) Die Histopathologie der oralen „hairy"
Leukoplakie. Hautarzt 39: 213-216
63. Zhang X, Langford A, Becker J et al. (1988) Ultrastructural and
immunohistochemical findings in oral hairy leukoplakia. Virchows Archiv [A]
412: 533-542
64. Zeitz M (1992) Störungen des darmassoziierten Immunsystems. In: Goebel H
(Hrsg) Gastroenterologie. Springer, Berlin Heidelberg New York Tokyo (Innere
Medizin der Gegenwart, Bd 11, S 598-606) |
|
|
|
Wenn Sie den Mut haben und die
Wahrheit
vertragen können!
Sie finden nachfolgend weitere
medizinische Bilder
über die Folgen widernatürlicher Sexualpraktiken. |
|
Eines wollen wir
klarstellen! |
|
Homophobie
bezeichnet hauptsächlich eine
soziale,
gegen Lesben und Schwule
gerichtete Aversion bzw.
Feindseligkeit,
(lt. Wikipedia, 2010)
Wir haben keine Aversion bzw.
Feindseligkeit
gegen
Lesben
und
Schwule !!
aber
Wir sorgen uns um Eure
Gesundheit !
|
|
- anschließend wird es hart, sehr
hart - |
|
Bild 1
Bild 2
Bild 3
Bild 4
Bild 5
Bild 6
Bild 7
Bild 8
Bild 9
Bild 10
Bild 11
Bild 12
Wenn Sie sich auch diese Bilder
angeschaut haben und realistisch nachdenken,
wollen Sie in Zukunft mit diesem
Gefahrenpotential weiter so leben? |
|
|
|
|
|
|
|
Krankheiten gehören behandelt
und nicht gefeiert!
Martin Humer |
|
|
|
|
|
|
|
|
Impressum
E-Mail |
Copyright © 2010 Babycaust.de / Aktualisiert:
28.07.2020 |
|